Zusammenfassung
Eine multizentrische, offene Behandlungsoptimierungsstudie der Phase 3b mit oralem Asciminib bei Patienten mit chronischer myeloischer Leukämie in der chronischen Phase (CML-CP), die zuvor mit 2 oder mehr Tyrosinkinase-Inhibitoren behandelt wurden.
Studienzweck
Asciminib ist ein BCR-ABL-1 Inhibitor mit einem neuartigem Wirkmechanismus mit vielversprechender Aktivität bei CML. Asciminib belegt die Myristat-bindende Tasche von ABL und bewirkt dadurch eine allosterische Hemmung der Tyrosinkinase.
Der Zweck der aktuellen Studie ist die Optimierung der Behandlung mit Asciminib in zwei unterschiedlichen Dosierungen, in Patienten mit CML-CP, die zuvor mit 2 oder mehr Tyrosinkinase-Inhibitoren (TKIs) behandelt wurden und diese nicht vertragen bzw. mit dieser Standardbehandlung kein entsprechendes Ansprechen, per European Leukemia Network (ELN) Guideline 2020, erreicht haben.
Studienaufbau
- Voruntersuchung
- Randomisierung in zwei Behandlungsarme (1:1; Asciminib 40mg BID oder Asciminib 80mg QD)
- Behandlungsphase bis zu maximal 144 Wochen (Dosiserhöhung auf 200mg QD möglich bei Patienten, die nach 48 Wochen keine MMR erreichen oder das Ansprechen in Woche 48 – 108 verlieren, wenn nach Ansicht des Prüfarztes der Patient von einer Dosiserhöhung profitieren könnte)
- Sicherheitsnachbeobachtung, 30 Tage nach Behandlungsende
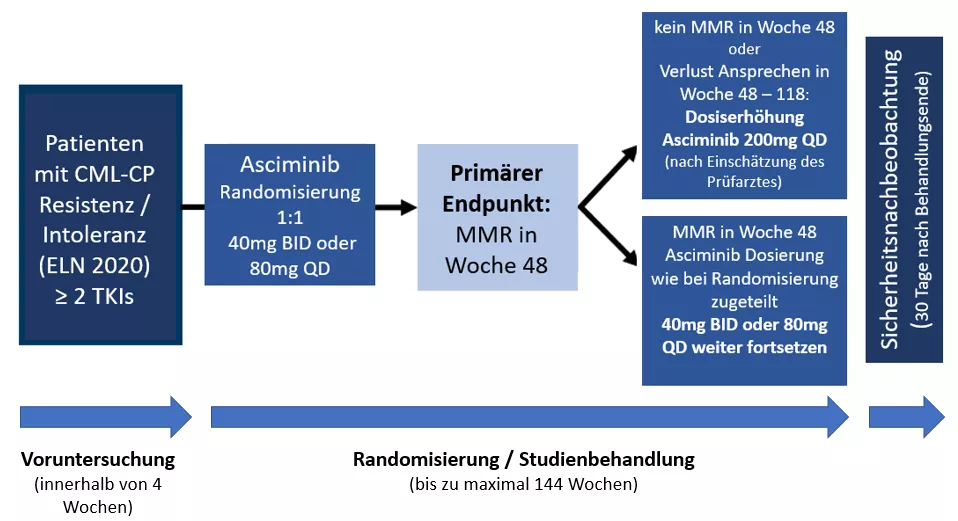
Ablauf der Studie
Es werden etwa 186 Patienten an dieser klinischen Prüfung teilnehmen. Während der gesamten Laufzeit der Studie (etwa 3 Jahre) sind maximal 17-18 Besuche an der Klinik/am Prüfzentrum erforderlich. Bei den einzelnen Klinikbesuchen werden unterschiedliche Untersuchungen wie z.B. körperliche Untersuchung, Blutabnahmen, Untersuchung des Herzens stattfinden. Eine Entnahme einer Knochenmarkprobe wird im Verlauf der Studie zu 3 Zeitpunkten (zu Beginn, nach ca. einem Jahr und am Ende der Studie) erforderlich sein.
Voraussetzung zur Teilnahme
Wichtige Kriterien für die Teilnahme an der Studie sind:
- Diagnose von CML-CP (chronische myeloische Leukämie)
- Behandlung mit mindestens 2 oder mehr vorhergehenden TKIs (Imatinib, Nilotinib, Dasatinib, Bosutinib oder Ponatinib)
- Anzeichen für Therapieversagen (per ELN 2020 Guidance) oder Unverträglichkeit gegen der vorhergehenden TKI Behandlung
Patienten mit einer bestätigten BCR-ABL1 T315i Mutation oder Patienten mit einer vorhergehenden Stammzelltransplantation bzw. Patienten, die für eine Stammzelltransplantation in Frage kommen können, NICHT an der Studie teilnehmen.
Bestimmte gesundheitliche Einschränkungen oder die Einnahme bestimmter Medikamente können Ausschlusskriterien sein. Über die genauen Ein- und Ausschlusskriterien für die CABL001A2302 Studie kann Sie der Prüfarzt informieren, der auch die Entscheidung der Studienteilnahme trifft.
Nur aktive, rekrutierende Zentren bzw. solche, deren Zustimmung schriftlich vorliegt werden auf der Homepage veröffentlicht.
Weitere Informationen
Medizinische Universität Graz – LKH
Klin. Abt. f. Hämatologie
Auenbruggerplatz 38
8036 Graz
Kontaktperson: Univ. Prof. Dr. Albert Wölfler
Tel. +43 (0) 316 385 84086
Email: [email protected]
Hanusch Krankenhaus
3. Med. Abteilung, Hämatologie u. Onkologie
Heinrich-Collin-Straße 30
A-1130 Wien
Kontaktperson: OA Dr. Thamer Sliwa
Tel. +43 (0)1 910 21 85542
Email: [email protected]
Ordensklinikum Linz Barmherzige Schwestern - Elisabethinen
Abteilung Interne 1
Seilerstätte 4
4010 Linz
Kontaktperson: Prim. Univ. Prof. Dr. Andreas Petzer
Tel. +43 732 7677 7345
Email: [email protected]