Die Bedeutung von Maschinellem Lernen (ML) nimmt auch in der Gentherapie zu. Das liegt unter anderem daran, dass die Menge an analysierbaren Gendaten enorm zugenommen hat, da Genanalysen heutzutage sehr viel kostengünstiger und schneller durchgeführt werden können. Riesige Mengen an Analyse-Daten sind wiederum eine Voraussetzung, um mit Hilfe von ML zu aussagekräftigen Ergebnissen zu gelangen.
Maschinelles Lernen: Computer Algorithmen, die sich automatisch durch Erfahrung und Datenverwendung verbessern.1 Maschinelles Lernen ist ein Teilgebiet der Künstlichen Intelligenz.
Die Anwendungsgebiete von ML in der Gentherapie sind vielfältig: Sie reichen von der Entdeckung von versteckten DNA-Mustern – die z. B. mit einer bestimmten Erkrankung in Verbindung stehen – bis hin zur Entwicklung und Optimierung von Gentherapien, auf die wir in diesem Artikel eingehen werden.
Gentherapien optimieren
Um zu verstehen, warum und wie man Gentherapien optimieren kann, starten wir zuerst mit den Grundlagen.
Was sind Gene?
Der menschliche Körper besteht aus etwa 100 Billionen Zellen – aneinander gereiht würden sie etwa 60 Mal um die Erde reichen2. Im Kern (Nukleus) jeder dieser Zellen befinden sich Chromosomen, die aus einer dicht gepackten DNA-Struktur bestehen. Auf dieser DNA wiederum sind alle vererbbaren Informationen eines Organismus in bestimmten Abschnitten gespeichert – den Genen.3
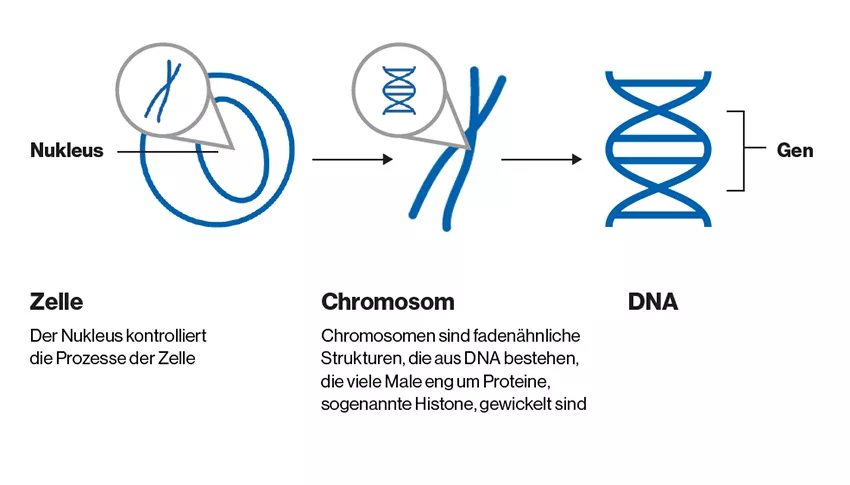
Diese Gene bestimmen einerseits unser Aussehen - etwa ob wir blaue oder braune Augen haben – andererseits können Genveränderungen krankmachen: Wenn Gene krankhaft verändert (mutiert) sind, kann die Geninformation nicht korrekt vom Gen abgelesen werden und der Körper produziert fehlerhafte Proteine und Zellen, die zu schweren Erkrankungen führen können4. Diese Veränderung können angeboren sein oder an späteren Zeitpunkten im Leben spontan auftreten.
Bei der Gentherapie werden krankmachende Gene ersetzt, verändert oder inaktiviert. Das neue Gen wird in einem Vektor – meist ein inaktiver, nicht-krankheitserregender Virus – in die Zelle zu der DNA im Zellkern transportiert. Wie das im Detail funktioniert, erfahren Sie hier: https://www.novartis.at/stories/entdecken/personalisierte-medizin-fuer-kranke-gene
Dem Transportvehikel der DNA – dem Vektor – kommt dementsprechend eine wichtige Funktion zu, die entscheidend für den Therapieerfolg ist. Als Vektor werden z. B. adeno-assoziierte Viren (AAV) verwendet, da AAV als sichere Vektoren gelten, die nicht in Verbindung mit Erkrankungen stehen.5
Allerdings gibt es in einem AAV-Vektor nur begrenzt Platz für Gene, die in die Empfängerzellen transportiert werden sollen. 6 Deshalb eignen sie sich nicht als Vektoren für große Gene und können nicht für bestimmte Therapiebereiche eingesetzt werden, in denen große Gene in die Zellen transportiert werden müssen.
An diesem Punkt kommt ML ins Spiel: Mittels ML Methoden kann man eine große Auswahl and modifizierten AAV Vektoren generieren, die auch große Gene in Körperzellen transportieren können. 6 Genau daran arbeitet auch Novartis gemeinsam mit seinem Kollaborationspartner Dyno Therapeutics.
Warum braucht es dafür ML?
Die Superkraft des ML ist, dass ein ML Modell bestimmte Regeln lernen kann, anhand derer es komplexe Prozesse auf Basis von Eingabedaten simulieren und Ergebnisse hervorsagen kann. Gerade große und komplexe Datensätze stellen oft eine große Herausforderung für traditionelle Entwicklungsmethoden dar – für ML Methoden ist aber gerade das eine hervorragende Grundvoraussetzung. 6
So kann ML arbeits- und ressourcen-intensive Experimente im Labor durch „Experimente am Computer“ ersetzen. Je mehr Daten zu der Problemstellung zur Verfügung stehen, umso genauere Ergebnisse liefert das ML Modell. Diese weitaus kostengünstigere und schnellere Anwendung ermöglicht biologische Strukturen zu identifizieren, die mit herkömmlichen Experimenten im Labor allein gar nicht erreicht werden könnten. 6
Um mittels ML einen passenden AAV Vektor für Gentherapien zu finden, der genügend Platz für die zu transportierenden Gene hat, gibt es unterschiedliche Ansätze:
- ML Algorithmen können lernen, die Funktion aus einer bestimmten Basensequenz – Basen sind die Bausteine der DNA – vorherzusagen. Diese Sequenz-Funktions-Beziehungen kann der ML Algorithmus automatisch aus großen Datensätzen lernen, die viele Sequenzen von Vektoren sowie deren Eigenschaften beinhalten. 6
- Modernes ML kann Hilfsdaten verwenden, um zusätzliche Informationen zu generieren, wenn nicht ausreichend Daten zur Verfügung stehen.
Ein Beispiel wäre der „Style-Transfer“: Dabei werden vom ML Algorithmus unterschiedliche Malstile von Kunstwerken erlernt, die dann beliebig auf neue Bilder angewandt werden können. So kann man einem ML Modell den Malstil von Van Gogh antrainieren und dann seine eigenen Fotos im Stil von Van Gogh mit Hilfe des ML Modell generieren lassen. Dieses Prinzip kann man auch in biologischen Fragestellungen anwenden.
Möchte man nun etwa optimierte AAV erstellen und hat dazu nicht ausreichend Daten, kann man ein ML Modell mit Daten von Proteinen trainieren, die den AAV ähnlich sind. Das ML Modell wird durch die ähnlichen Proteine Regeln über deren Funktionsweise lernen, die potenziell auch für AAV gelten und auf sie anwendbar sind.
Mittlerweile ist der Einsatz von ML in der Forschung nicht mehr wegzudenken, da so neue Entwicklungen schneller und effizienter vorangetrieben werden können. Diesen Weg beschreiten auch wir bei Novartis und möchten mit unserem Fokus auf Data & Digital dazu beitragen, Zell- und Gentherapien für unsere Patientinnen und Patienten rasch zu entwickeln und weiter zu optimieren.